The research team led by Yao Honghong from Southeast University has developed a nucleic acid drug with the potential to suppress microglial cell activity and possess antidepressant properties.
Extracellular vesicles (EVs) are various membrane-structured vesicular structures (40-100 nm) released by cells. Due to their low immunogenicity, biodegradability, low toxicity, and the ability to cross the blood-brain barrier, EVs have become prospective drug carriers in the fields of immunotherapy, regenerative medicine, etc., and have emerged as a vehicle for novel drug delivery systems.
Circular RNA DYM (circDYM) is derived from exons 4, 5, and 6 of the DYM gene. It can act as a "sponge" for miRNA 9 to adsorb and inhibit miRNA, thus playing a regulatory role. In 2018, the research team led by Yao Honghong from the Department of Pharmacology, School of Medicine, Southeast University discovered that the overexpression of circDYM in the hippocampal region could inhibit the activity of miRNA 9, ultimately reducing microglial cell activation and alleviating depression-like behaviors.

On January 13, 2022, based on the above research achievements, the research team led by Yao Honghong constructed extracellular vesicles that target the central nervous system and encapsulate circDYM (RVG-circDYM-EVs), which effectively alleviated the depression-like behavioral disorders caused by chronic stress. They successfully developed circular RNA into a nucleic acid drug.
In 2011, a new method for targeted delivery of siRNA using exosomes was developed. The surface membrane protein lamp2b of exosomes was modified and fused with the neuron-specific rabies virus glycoprotein (RVG) to form exosomes with the RVG-lamp2b fusion protein. Through the method of electroporation, exogenous short-chain RNA interference was made to enter the exosomes. The RVG on the surface of the exosomes binds to the acetylcholine receptor to specifically release the short-chain RNA interference into neurons, significantly down-regulating the expression of BACE1, a protein related to Alzheimerd's disease.
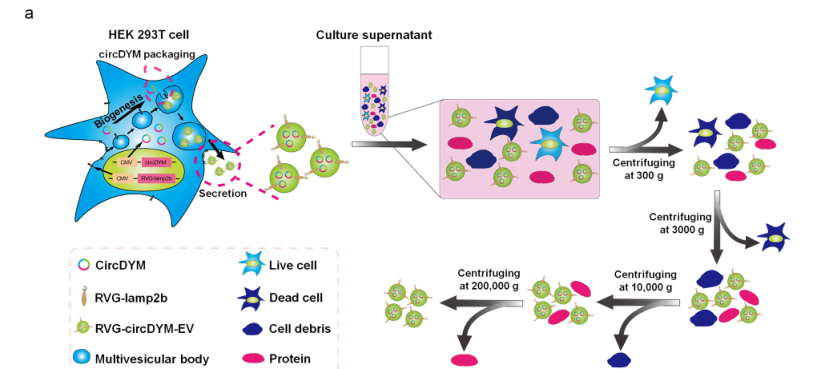
Through a similar method, the researchers constructed the RVG - circDYM - EVs system. Using exosomes as carriers, they achieved the over - expression of circDYM with nicotinic acetylcholine receptor targeting (Figure 1). Two hours after the tail - vein injection of 200 μg of RVG - circDYM - EVs, this exosome system began to enrich in the liver, kidneys, heart, spleen, brain and other parts of the mice (Figure 2). Among them, the liver had the highest enrichment and expression. Over time, the content of exosomes gradually decreased.
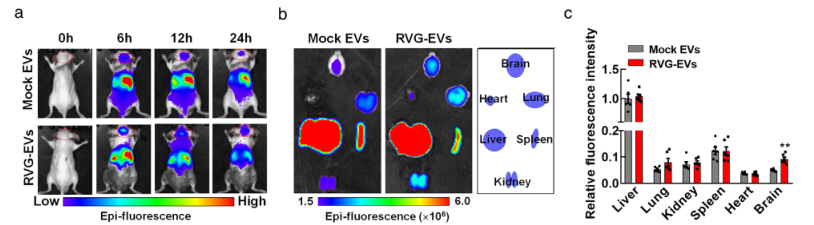
Furthermore, RVG - circDYM - EVs can be specifically expressed on microglia, neurons and astrocytes in the hippocampal region. This indicates that the exosomes with nicotinic acetylcholine receptor - targeted over - expression of circDYM can penetrate the blood - brain barrier and enter the mouse brain, and are evenly distributed.
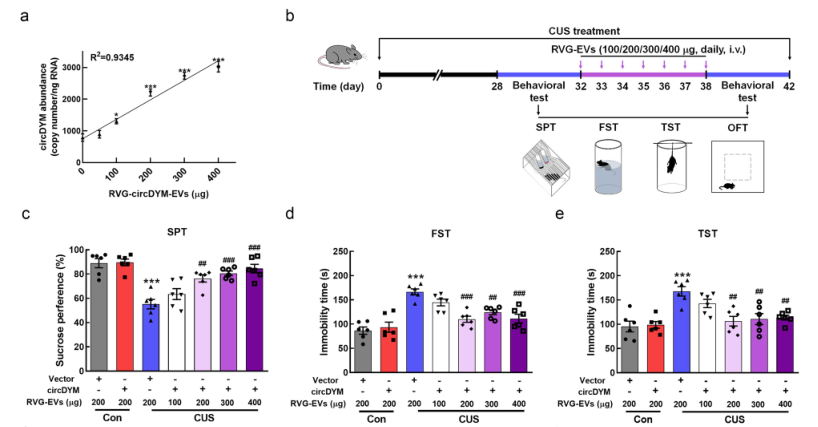
In vitro cell experiments revealed that RVG - circDYM - EVs could reduce the activation of microglia induced by lipopolysaccharide: the expressions of iNOS, IL - 6, IL - 1β and MCP - 1 were decreased. Subsequently, after tail - vein injection of 100, 200, 300 and 400 μg of RVG - circDYM - EVs to mice with depression - like behavior caused by chronic stress, the 200, 300 and 400 μg dose groups could significantly improve the depression - like behavior of the mice (Figure 3).
To further explore the molecular mechanism by which RVG - circDYM - EVs regulate the activity of microglia, the researchers found through single - cell sequencing that the transcription factor TATA - box binding protein - associated factor 1 (TAF1) protein could regulate more than 10 differentially expressed genes and interact with circDYM, co - localizing in the cytoplasm of microglia. In vitro experiments showed that over - expression of TAF1 promoted the expressions of Trpm6 and Cyp39a1, and over - expression of circDYM could inhibit this promoting effect.
Lipopolysaccharide could promote the binding of TAF1 to the promoters of Trpm6 and Cyp39a1, and knockdown of either Trpm6 or Cyp39a1 could block the increase in iNOS levels caused by lipopolysaccharide. These molecular experiments indicated that circDYM could directly regulate the activation of microglia through TAF1.
Chronic stress could cause a decrease in the expression of tight - junction proteins in the hippocampal region, an increase in the permeability of the blood - brain barrier, and ultimately lead to the infiltration of peripheral immune cells such as CD4 - positive T cells, CD8 - positive T cells and B220 - positive B cells into the brain parenchyma. Treatment with RVG - circDYM - EVs could partially repair the blood - brain barrier and reduce the infiltration of peripheral immune cells.
It is reported that the RVG - circDYM - EVs developed in this paper was applied for a patent on February 13, 2020. The application name is: Exosomes with nicotinic acetylcholine receptor - targeted over - expression of circDYM and their preparation methods and applications.